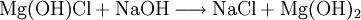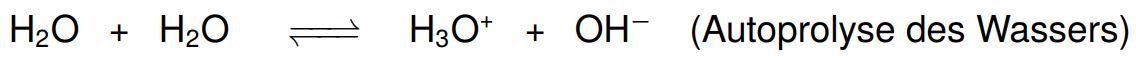Ampholyte (zusammengesetzt aus griechisch αμφίς amphis = „auf beiden Seiten“, und λύσις lysis = „Auflösung“) oder Säure-Base-Ampholyte beziehungsweise Säure-Base-Amphotere, genannt auch amphiprotische Verbindungen, sind chemische Verbindungen, die sowohl als Brønsted-Säure als auch als Brønsted-Base reagieren können. Dieses Verhalten bezeichnet man auch als Säure-Base-Amphoterie. Amphotere können sowohl Protonen aufnehmen als auch abgeben.
Eigenschaften
Die Wasserlöslichkeit der Ampholyte hängt stark vom pH-Wert ab. Manche Ampholyte reagieren mit sich selbst, das bekannteste Beispiel dafür ist Wasser. Es reagiert mit Säuren zu H3O oder mit Basen zu OH−, dieses Verhalten zeigt sich auch in reinem Wasser als Autoprotolyse:
Beispiele für Ampholyte
Verbindungen, die zur Autoprotolyse neigen
Beispiele (Autoprotolysekonstanten pKau nach):
- Wasser H2O (pKau=14)
- Ammoniak NH3 (pKau=29 bei −50 °C)
- Schwefelsäure H2SO4 (pKau=3,85)
- Ameisensäure HCOOH (pKau=6,2)
- Methanol CH3OH (pKau=16,9)
- Ethanol CH3CH2OH (pKau=19,5)
- Fluorwasserstoff HF (pKau=10,7 bei 0 °C)
Die angegebenen Autoprotolysekonstanten entsprechen dem negativen dekadischen Logarithmus (s. a. pH-Wert) des Ionenprodukts der Stoffe. Mit steigender Temperatur nimmt das Ausmaß der Autoprotolyse für gewöhnlich zu.
Reaktionsbeispiel: Wasser
Reagiert mit Säure als Base:
Reagiert mit Base als Säure:
Teilweise deprotonierte mehrprotonige Säuren
Beispiele:
- Monohydrogenphosphat HPO42−
- Dihydrogenphosphat H2PO4−
- Hydrogensulfat HSO4−
- Hydrogencarbonat HCO3−
Reaktionsbeispiel: Dihydrogenphosphat
Reagiert mit Säure als Base:
Reagiert mit Base als Säure:
Teilweise protonierte mehrwertige Basen
Beispiele:
- basisches Magnesiumchlorid Mg(OH)Cl bzw. Mg(OH) Cl−
- Hydrazin Monohydrochlorid H2N-NH2 · HCl bzw. H2N-NH3 Cl−
Reaktionsbeispiel: basisches Magnesiumchlorid
Reagiert mit Säure als Base:
Reagiert mit Base als Säure:
Verbindungen mit sauren und basischen funktionellen Gruppen
Verbindungen mit mindestens je einer sauren und basischen funktionellen Gruppen sind ebenfalls amphotere Stoffe, so beispielsweise:
- Aminosäuren mit ihren sauren Carboxygruppen und basischen Aminogruppen (und somit auch Peptide und die meisten Proteine)
- Zwitterionen
Reaktionsbeispiel: Glycin (einfachste Aminosäure)
Reagiert mit Säure als Base:
Reagiert mit Base als Säure:
Berechnen des Eigen-pH-Werts von Ampholyten
Löst man Ampholyte (mit zwei funktionellen Gruppen) in Wasser, so stellt sich ein mittlerer pH-Wert ein, der sich mit folgender (für nicht allzu starke Verdünnungen konzentrationsunabhängigen) Näherungsformel, auch „Ampholytgleichung“ genannt, berechnen lässt.
Dabei sind pKS1 und pKS2 die Säurekonstanten (pKS-Werte) der jeweiligen Dissoziationsmöglichkeiten des Ampholyten.
Elektrisch neutrale Ampholyte, z. B. Aminosäuren, haben bei diesem pH-Wert außerdem die niedrigste Löslichkeit; sinkt oder steigt der pH-Wert, nimmt die Löslichkeit dagegen wieder zu, da mit der Ladung die Solvathülle stabilisiert wird.
Siehe auch
- Dissoziation (Chemie)
- Protolyse
Weblinks
Einzelnachweise