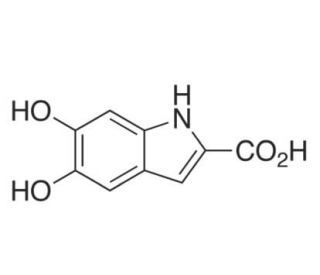
5,6-Dihydroxyindol-2-carbonsäure-Oxidase, kurz DHICA-Oxidase (Gen: TYRP1, von früher Tyrosinase related protein 1 (Trp-1)) ist dasjenige Enzym, das 5,6-Dihydroxyindol-2-carbonsäure in Melanin umwandelt. Damit ist es unentbehrlich für einen von zwei Stoffwechselwegen, über die das Pigment Melanin in Melanocyten aufgebaut wird. Mutationen am TYRP1-Gen sind verantwortlich für Okulokutanen Albinismus Typ 3. Tiere, die mit diesem Enzym immunisiert werden, zeigen die Symptome des Vogt-Koyanagi-Harada-Syndroms. Ein Allel von TYRP1 im Menschen ist typisch für Einwohner der Salomonen mit blondem Haar. Auch wenn diese der europäischen Ausprägung ähnlich sehen, kommt dieses Allel nicht in Europäern vor. Wahrscheinlich ist die Variation 10.000 Jahre alt.
Katalysierte Reaktion
2 Ox. Akz. ⇒
⇒ 2 Red. Akz. CO2
Von DHICA wird oxidativ der Carbonsäurerest abgespalten, und das Produkt polymerisiert zu Eumelanin, einem braun-schwarzes Pigment, das zusammen mit weiteren Pigmenten Haut und Haaren die Farbe verleiht.
Weitere Funktionen
DHICA-Oxidase bildet Heterodimere mit Tyrosinase, stabilisiert diese und trägt so möglicherweise zur Regulation der Melaninsynthese durch Bildung eines Proteinkomplexes bei, dessen Transkription von einem Protein namens Mitf aktiviert wird.
Hemmung
Der Wirkstoff Rucinol soll die Pigmentbildung gezielt durch Hemmung der Tyrosinase und des TRP-1 hemmen.
Literatur
- Braune Haut, blonde Haare. In Neue Zürcher Zeitung. 8. Mai 2012 (nzz.ch).
Weblinks
Einzelnachweise


![5,6DIHYDRO2,3DIMETHOXY6,6DIMETHYLBENZ[7,8]INDOLIZINO[2,3B](https://structimg.guidechem.com/11/59/223258.png)